电化学中让人挠头的各种“势”
电势(electric potential)、化学势(chemical potential)、电化学势(electrochemical potential)这些概念都是什么意思?电压表能不能测量两点之间的电势差?电势差是不是决定了带电粒子的运动?
其实,电化学中有各种带“势(potential)”的概念可不止上述三个,它们不但名字相似,所表达的含义也相关,非常容易使人造成混淆和误解。近日, ACS Energy Letters 杂志编辑顾问委员会(Editorial Advisory Board)成员、美国 俄勒冈大学的 Shannon Boettcher教授等人发表论文,为读者梳理了关于电势、化学势、电化学势、电极电势(electrode potential)、溶液电势(solution potential)、过电势(overpotential)及其相关概念。


表1. 电化学中有各种“势”及应用。图片来源: ACS Energy Lett.
电势( ϕ )是物理电学中的基本概念,从参考点(通常指无穷远处)到特定位置所经过路径上电场的积分:
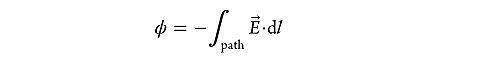
化学势( )指的是吉布斯自由能相对物种 j 粒子数的变化率,当温度、压力和所有其他物种的浓度不变时,可以通过偏导数来表示,因此化学势又被称作偏摩尔吉布斯自由能:
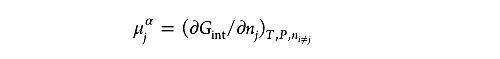
其中, Gint 是忽略“长程”静电效应贡献的吉布斯自由能, nj 是物种 j 的摩尔数。
在物理学中,对 电化学势( )通常没有明确地定义,由于在定义化学势( )时没有考虑静电效应,因此在化学势的基础上加上静电能 ,形成了一个新的物理量,通常将这一物理量定义为 电化学势( ):
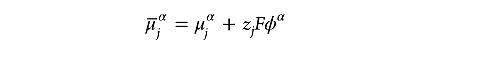
回到开头提到的问题,电势差是不是决定了带电粒子的运动?举半导体物理中的一个典型例子,将一块p型材料和n型材料接触,会在其界面形成pn结,同时两个材料之间电压为0(有电压就变成电池了)。在建立平衡态之前,由于载流子浓度梯度的存在,空穴和电子分别向相反方向扩散而留下无法自由移动的电离杂质,这些电离杂质会形成从n指向p的内建电场,而内建电场会驱动载流子发生漂移,其漂移方向与扩散方向相反,最终会在结区建立动态平衡态,此时扩散电流等于漂移电流。
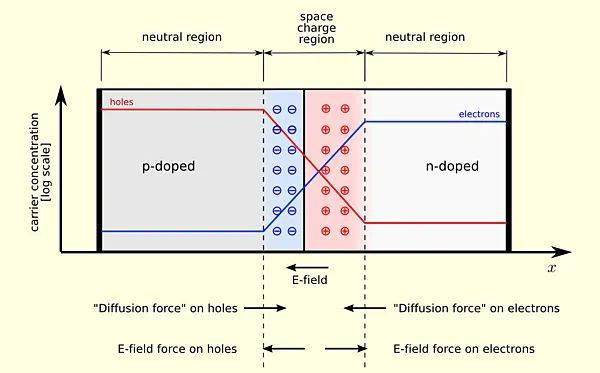
p-n结及载流子迁移。图片来源:Wikipedia [1]
由此可见,电化学势差,才是导致带电粒子发生定向迁移的根本原因。这和重力势的概念很类似:一个球从山上滚下,可以看作它从高重力势跑到了低重力势的区域。化学反应的发生,也总是朝着热力学上有利的方向发展,尽量减少自由能。带电粒子如同从山上滚下的球,趋向于从高电化学势向低电化学势移动,因此,电化学势决定了物种之间反应的驱动力和移动的方向,粒子 j 的移动通量(J,单位通常为mol•c m−2 • s−1 )也是根据电化学势来定义的:
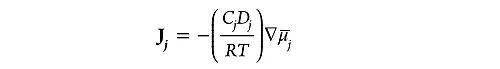
其中, Cj 和 D j 是物种 j 的浓度和扩散系数(单位通常为mol•c m−3 和c m2 • s−1 ),而 是电化学势差,是物种 j 移动的潜在驱动力。
实际上,只有当测试的两点具有相同的化学势时,电压表才能测量它们之间的电势差。 测试有条件,推论需谨慎(“any inferences about electric potential require one or more assumptions”),想必这是研究者在审阅了无数稿件后,向撰稿人们发出的来自内心的呼喊。
很多电化学中概念的实验测量,如电极电势、溶液电势、膜电势、过电势等,都与电化学势有关。 电极电势( Ewe),就是通过电化学势来定义的,按照惯例,参比电极通常采用标准氢电极(SHE),它的电势为0 V。而工作电极相对参比电极( Ere)的电势为:
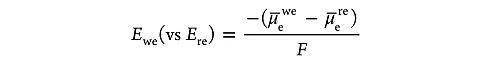
电池电压通常写为 Ecell= Ewe– Ere,而开路电压则是与工作电极和参比电极上发生的整个电化学反应的吉布斯自由能变化有关:
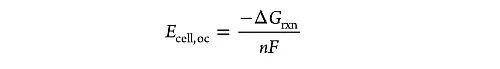
溶液电势( Esol)相对比较复杂,用来描述电极和电解质界面处的变化。电极和电解质溶液中的电化学势最初是不同的,一旦两相接触,带电粒子会受到界面上电化学势差的驱动,使得离子与金属上的电荷相匹配。溶液电势可由能斯特方程给出,并且其与溶液费米能级直接相关:
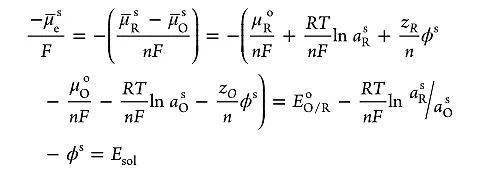
不过,如果溶液中的氧化还原电对具有缓慢的电化学动力学(例如 O2 /H2 O电对),溶液电势很难准确测量。
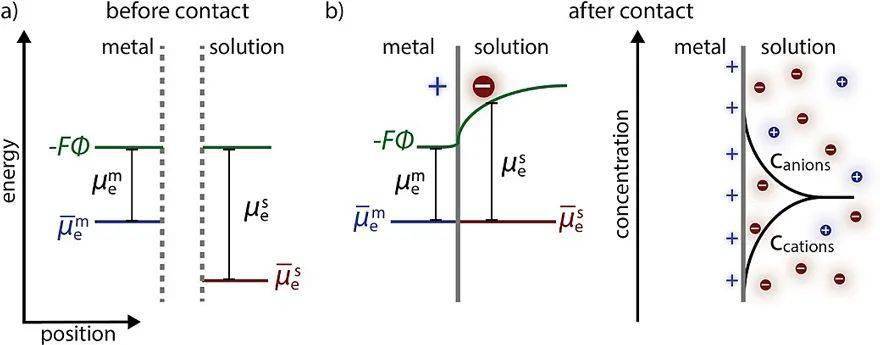
电极-电解质界面的电化学平衡。图片来源: ACS Energy Lett.
如果在溶液中加入一层半透膜,会发生什么呢?例如我们的生物膜或者一些聚合物离子交换膜,假设膜两边是不同浓度的KCl水溶液,理想状态下只能允许阳离子通过,则整个系统中 K+ 的电化学势平衡,而氯离子无法平衡。这种现象被称作吉布斯-唐南效应(Gibbs–Donnan effect),两溶液间因此产生的电势称作唐南电势(Donnan potential)。
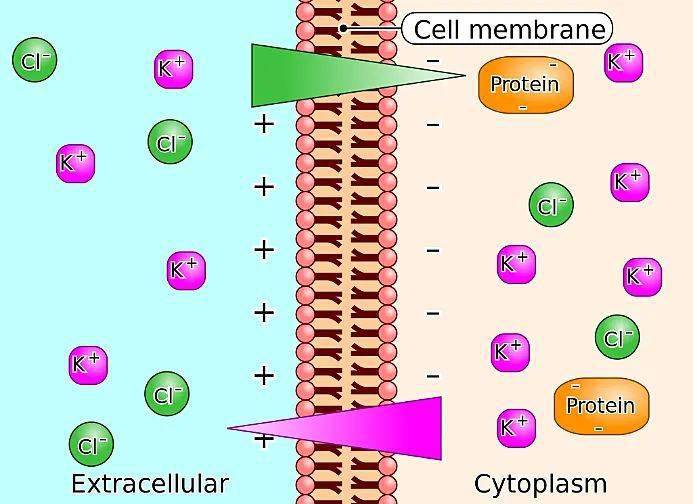
细胞膜的唐南平衡。图片来源:Wikipedia [2]
尽管前边提到,电压表测量的是电化学势的差异而不是电势的差异,但由于电压表为电子提供了高阻抗路径,因此达到平衡的速度足够慢,不会影响膜电势的测量。
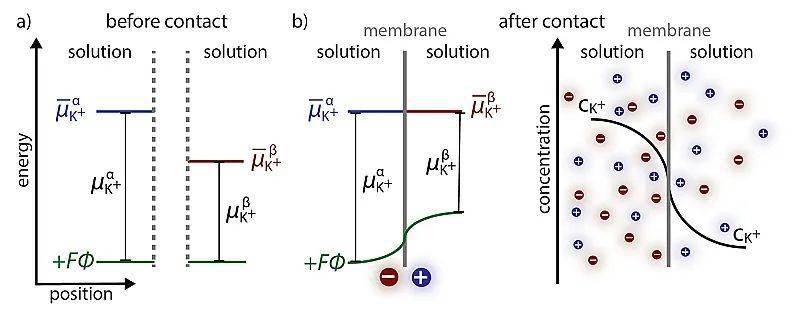
阳离子交换膜两侧电化学平衡。图片来源: ACS Energy Lett.
另一个常见的例子是燃料电池。电池的开路电压理论值为1.23 V,然而实际的输出电压总是小于1.23 V,难以达到理论值。其原因是当有电流通过电极时,动力学限制等因素将产生过电势( η ):
式中, Eapp是施加的电极电势,而 Erev是氧化还原反应的可逆电势,过电势表示外加电极电势与目标电化学反应平衡时的电极电势之差。
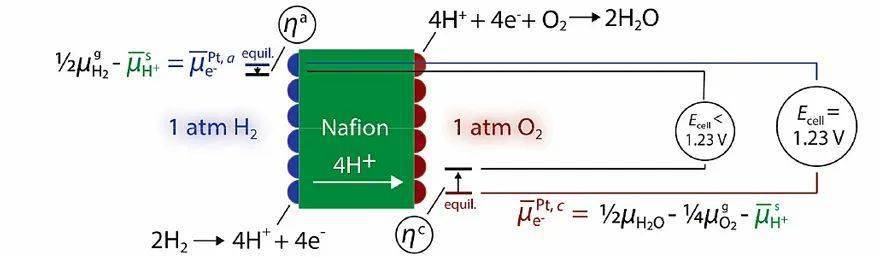
燃料电池中的电化学电势。图片来源: ACS Energy Lett.
最后,研究者为读者和研究者提出几点建议:
1)测量势差的结果,必然得到总自由能差。总自由能可分解为活度、电势和其他方面的差异,需建立模型和假设来描述。
2)物种的迁移是由电化学势的空间梯度决定的。一般来说,电场不是带电物种移动的必然条件。
3)在平衡状态下,任何给定物种在整个体系中的电化学势必须相同。对于任何化学反应,反应物的电化学势之和必须等于产物的电化学势之和。在实际系统中,慢动力学过程在热力学平衡分析中通常可以被忽略。
4)如果没有明确概念,应尽量避免单独使用“potential”一词,毕竟它可以表示很多含义。在电化学中,“potential”通常用来表示电化学势。如果要表示电势或化学势,应明确指出,同时相应的物种及相也应该指出。
Potentially Confusing: Potentials in Electrochemistry
Shannon W. Boettcher*, Sebastian Z. Oener, Mark C. Lonergan, Yogesh Surendranath, Shane Ardo, Carl Brozek, Paul A. Kempler
ACS Energy Lett., 2021, 6 , 261–266, DOI: 10.1021/acsenergylett.0c02443
参考文献
[1]https://en.wikipedia.org/wiki/P%E2%80%93n_junction
[2]https://en.wikipedia.org/wiki/Gibbs%E2%80%93Donnan_effect
(本文由 小希供稿)
本文版权属于 X-MOL(x-mol.com),未经许可谢绝转载!欢迎读者朋友们分享到朋友圈or微博!










